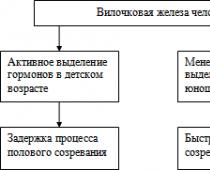
Жировой болезнью печени (синонимы: жировой гепатоз, стеатогепатоз, жировая инфильтрация печени) называют патологическое состояние, при котором 5 и более процентов общей массы печени составляют клетки жировой ткани. Причина данной патологии - в тяжелом нарушении жирового и углеводного обмена в организме, к которому приводят нерациональное питание с преобладанием в рационе «быстрых» углеводов и «вредного» холестерина; злоупотребление алкогольными напитками; нарушение толерантности к глюкозе и сахарный диабет, ожирение, некоторые наследственные нарушения обмена веществ, вирусный гепатит В или С, прием некоторых лекарственных препаратов (в частности, НПВС) на протяжении длительного времени.
Жировое перерождение печени развивается или при избыточном поступлении жирных кислот в печень или при чрезмерно высоком уровне липолиза (расщепления жировой ткани), поэтому о вероятности такой патологии необходимо помнить тем, кто мечтает в кратчайшие сроки избавиться от лишних килограммов. Бытует стереотип, что сама по себе жировая дистрофия печени неопасна, однако это не так: жировая инфильтрация гепатоцитов снижает их функциональную активность, повышает риск развития сахарного диабета, сердечно-сосудистых патологий, кроме того, при стеатогепатозе клетки печени со временем замещаются соединительной тканью - развивается фиброз, а затем и цирроз печени.
Важно придерживаться рационального питания, в особенности пациентам с избыточным весом,
Особая опасность данной патологии заключается в том, что она долго протекает бессимптомно, лишь в отдельных случаях проявляясь умеренным увеличением печени и дискомфортом или некоторой болезненностью в правом подреберье. Точный диагноз жировой дистрофии можно поставить только после лабораторных (биохимический анализ крови) или инструментальных (УЗИ, эластометрия) исследований.
Безусловно, как и любое другое заболевание, жировую дистрофию печени легче предупредить, нежели лечить. Поэтому очень важно придерживаться рационального питания, в особенности пациентам с избыточным весом, подтвержденной инсулинорезистентностью, страдающим вирусным гепатитом, принимающим длительными курсами НПВС и другие гепатотоксичные препараты. В рационе рекомендуется уменьшить количество продуктов, содержащих насыщенные жирные кислоты, заменив их пищей, богатой моно- и полиненасыщенными жирами. Общую калорийность рациона также следует снизить. Кроме того, таким пациентам рекомендован прием гепатопротекторов. Это широкая группа лекарственных препаратов растительного, животного или синтетического происхождения, оказывающих благотворное воздействие на функциональное состояние клеток печени, способствующих их регенерации. Такие препараты позволяют предотвратить развитие жировой дистрофии печени или замедлить ее прогрессирование.
Например, к гепатопротекторам относится препарат Легалон - его активное вещество, силимарин, особым способом получаемый из плодов расторопши пятнистой, восстанавливает структуру клеток печени, нормализует протекающие в ней биохимические процессы, стимулирует функционирование клеток, а также оказывает антиоксидантное действие. Благодаря уникальной системе очистки активные вещества этого немецкого препарата отличаются максимальной биологической доступностью для человеческого организма, что значительно отличает данный препарат от других гепатопротекторов растительного происхождения. Принимать его рекомендуется как для профилактики в дозировке 70мг по 3 капсулы в сутки, так и в составе комплексной терапии, увеличив дозировку до 140мг, также по 3 капсулы в сутки.
Жировая дистрофия печени - серьезная патология, легкомысленное отношение к которой недопустимо. Однако своевременное устранение предрасполагающих факторов, рационализация питания и прием гепатопротекторов позволят предотвратить или существенно замедлить жировое перерождение печеночных клеток.
Неалкогольная жировая болезнь печени (НАЖБП), или стеатоз, жировой гепатоз, стеатогепатоз – заболевание, при котором в клетках печени накапливается нейтральный жир, разрушающий их. Факторы риска – лишний вес и инсулинорезистентность на фоне сахарного диабета второго типа. Однако НАЖБП часто поражает и худых людей. Эта болезнь может привести к осложнениям, если вовремя не обратиться к врачу и не начать эффективное лечение.
- Нарушение обмена веществ при инсулинорезистентности – метаболическом синдроме с ожирением.
- Хронические заболевания желудочно-кишечного тракта.
- Интоксикации тяжелыми металлами, пестицидами, прочими ядами.
- Прием лекарств – пероральных контрацептивов, глюкокортикоидов, антибиотиков, никотиновой кислоты, статинов.
- Неправильное питание, резкое похудение либо набор веса.
- Вирусные гепатиты.
- Гептрал.
- Эссенциальные липиды (Резалют, Эссенциале форте, Эссливер, Фосфоглив).
- Экстракт расторопши (Силимар, Карсил, Гепабене).
- Витамины – фолиевая кислота, метилкобаламин, витамин U.
- Препараты урсо- и хенодезоксихолевой кислоты (Хенофальк, Урсофальк, Урсолив, Ливодекса, Урдокса).
- Защищают клетки от повреждения.
- Обладают желчегонным действием, подавляют разрастание микрофлоры в тонком кишечнике – СИБР, который играет важную роль в патогенезе стеатоза.
- Снижают уровень холестерина, оптимизируя жировой обмен.
- Насыщенные жиры – сало, жирное мясо, трансжиры в майонезе, маргарине, заменителях какао-масла.
- Жареного.
- Копченого.
- Консервации.
- Алкоголя.
- Мучных продуктов.
- Кофе.
Показать всё
Причины
Неалкогольная жировая болезнь печени (НАЖБП) – патология, при которой клетки органа наполняются нейтральными жирами, нарушающими функции. В дальнейшем гепатоциты лопаются из-за избытка липидов, и на их месте формируется сначала фиброз, а затем цирроз. Уменьшается функционально активная ткань, появляются другие нарушения, связанные с обменом веществ. В классификации заболеваний печени этой патологии отводится отдельное место.
Основные причины развития липидной инфильтрации:

Ожирение печени
Лечение
Жировой гепатоз – серьезное заболевание, которое может приводить к циррозу в случае, если лечение не назначено вовремя. Есть и хорошие новости – болезнь успешно корректируется с помощью сбалансированного питания, а также приема гепатопротекторов, народных средств.
Не последнюю роль в лечении липидной дистрофии играет нормализация обмена веществ и процессов пищеварения.

Как снизить уровень холестерина в крови
Гепатопротекторы
Существует множество гепатопротекторов, имеющих различные механизмы действия.
При стеатозной дегенерации печени применяются липотропные соединения, утилизирующие нейтральный жир из гепатоцитов. Для их химического состава характерно наличие метильных групп.

Основные препараты для лечения поражения в стадии стеатоза:

Жировой гепатоз печени - причины, симтпомы, лечение, народные рецепты и диета
Гептрал
Это липотропное соединение, имеющее название S-аденозилметионин. Присутствует и синтезируется в организме, необходим для производства новых клеток как донатор лабильных метильных групп. Участвует в синтезе различных нейромедиаторов и других важных веществ. Поэтому при стеатогепатозе снимает такие симптомы, как вялость, депрессия, апатия, проблемы с суставами.
S-аденозилметионин способствует утилизации нейтрального жира из печеночных клеток, нормализует липидный обмен. Обращает вспять процесс жировой инфильтрации, предотвращая фиброзирование и цирротические изменения. Оказывает положительное действие на детоксикационную функцию. Улучшает запасание глюкозы в виде гликогена – при сахарном диабете снижает ее уровень в крови за счет поддержания печеночных клеток.
Выпускается в форме таблеток и растворов для инъекций. Во внутривенных и внутримышечных уколах биодоступность препарата Гептрал составляет 95%, в то время как в пищеварительном тракте усваивается лишь 5%.
Эссенциальные фосфолипиды
Химическое название – фосфолипиды, которые включают несколько классов соединений – фосфотидилхолин (лецитин), фосфотидилинозитол, фосфотидилсерин.
Эти препараты относятся к липотропным соединениям, которые способствуют утилизации липидов, накопившихся в клетках и вызвавших жировое перерождение печени. Имея в своем составе метильные группы, они способствуют процессам регенерации органа, детоксикации.
Эссенциальные липиды улучшают усвоение жиров, являясь эмульгаторами, приводят в норму процессы пищеварения, обладая желчегонным эффектом. При жировой дегенерации печеночной ткани страдает желудочно-кишечный тракт, увеличивается склонность к образованию камней в желчном пузыре. Лецитин способствует снижению уровня холестерина в желчи, делая ее менее вязкой.
Фосфотидилинозитол повышает чувствительность клеточных рецепторов к действию инсулина, что важно при метаболическом синдроме – сахарном диабете 2-го типа.
Фосфоглив содержит глицирризиновую кислоту, что препятствует размножению вирусов при стеатогепатите.
Расторопша
Растение, экстракт которого обладает гепатопротекторным эффектом. Оказывает желчегонное действие. Является антиоксидантом – это необходимо при истощении глютатиона в печени, что происходит из-за интоксикаций.

Улучшает пищеварение и усвоение жирорастворимых витаминов, так как стимулирует отхождение желчи. Нормализует синтез белка в печени, препятствуя отекам. Способствует образованию гликогена из лишней глюкозы крови, что важно при метаболическом синдроме.
Применяется как дополнительное средство при жировой дегенерации. Оказывает положительное влияние на метаболизм при поликистозе яичников, которым часто сопровождает стеатоз у женщин.
Силимар, Карсил, Легалон содержат экстракт расторопши, а Гепабене еще и извлечение дымянки.
Витамины
Среди них тоже имеются липотропные соединения. Жировой гепатоз при болезнях пищеварения обусловлен дефицитом таких важных кофакторов, как метилкобаламин (В12) и фолиевая кислота. Без них восстановление печеночных клеток идет медленно, а нейтральный жир в гепатоцитах откладывается интенсивно.
Атрофический гастрит, повышенное бактериальное обсеменение тонкого кишечника вызывает дефицит кобаламина – внешнего фактора Кастла. При этом развивается анемия, увеличение печени и селезенки.
В метаболизм фолиевой кислоты вмешиваются антибиотики, сульфаниламиды. В печени после такой терапии могут накапливаться триглицериды, то есть нейтральные жиры.
Витаминоподобное соединение холин улучшает липидный обмен, повышает чувствительность клеток к инсулину, что способствует утилизации глюкозы. Содержится в репешке – лечебном растении.
Витамин U – тиоктовая или липоевая кислота. Применяется для детоксикации при отравлении тяжелыми металлами и другими ядами. Обладает липотропным действием при стеатогепатозе. Назначается при сахарном диабете второго типа как антигипоксическое средство и для снижения резистентности к инсулину.
Желчные кислоты
Урсолив, Урсосан, Урсофальк, Хенофальк – желчные кислоты. Обладают комплексным действием при жировой инфильтрации:

Диета
Результат лечения жировой инфильтрации зависит от правильного питания. При стеатозе необходимо отказаться от следующих продуктов:
Насыщенные жиры способствуют накоплению в гепатоцитах липидов. Жареное – источник свободных радикалов. Мучные продукты усугубляют инсулинорезистентность. Кофе увеличивает содержание гомоцистеина в крови – при этом на его связывание требуется большее количество донаторов метильных групп.
Неалкогольная жировая болезнь печени (НАЖБП) (синонимы: «жирная» печень, «жировая» печень, жировая дистрофия печени, жировая дегенерация печени, стеатоз печени) является распространенным хроническим заболеванием, объединяющим клинико-морфологические изменения в печени: стеатоз, неалкогольный стеатогепатит (НАСГ), фиброз и цирроз . НАЖБП тесно ассоциирована с ожирением, особенно абдоминальным, и метаболическим синдромом (МС), что значительно повышает кардиометаболический риск и отражается на заболеваемости, прогнозе и продолжительности жизни больных.
Эпидемиология
Распространенность неалкогольного стеатоза печени у жителей экономически развитых стран мира составляет в среднем 20—35%, неалкогольного стеатогепатита — 3% . В США стеатоз печени имеют 34% взрослого населения, в Японии — 29% . В России, по данным скрининговой программы по выявлению распространенности НАЖБП и ее клинических форм, проведенной в 2007 г. и охватившей 30754 человек, НАЖБП выявлена у 27% обследованных, причем 80,3% из них имели стеатоз, 16,8% — стеатогепатит и 2,9% — цирроз печени .
НАЖБП выявляется во всех возрастных группах населения, включая детей, но чаще (в 60—75% случаев) встречается у женщин в возрасте 40—50 лет c различными метаболическими нарушениями .
У больных ожирением распространенность различных клинических форм НАЖБП значительно выше, чем в общей популяции, и составляет, по данным исследований, 75—93%, причем НАСГ диагностируется у 18,5-26%, фиброз - 20-37%, цирроз печени у 9-10% больных . При морбидном ожирении частота встречаемости НАЖБП возрастает до 95-100%. Среди больных СД2 НАЖБП выявляется у 50-75% пациентов .
Механизмы развития НАЖБП
Среди множества факторов и механизмов (ожирение, инсулинорезистентность, гипертриглицеридемия, прием некоторых лекарственных препаратов, синдром мальабсорбции, липодистрофии, болезнь Вильсона-Коновалова и др.), которые могут способствовать развитию НАЖБП, большинство исследователей в первую очередь выделяют значимость инсулинорезистентности/ гиперинсулинемии и ожирения, особенно висцерального .
Патогенез НАЖБП сложен и включает механизмы, ассоциированные с ожирением и воспалением: инсулинорезистентность, приводящую к оксидативному стрессу, эндотелиальной дисфункции, хроническому воспалению, и изменение секреции адипоцитокинов .
Результаты клинических исследований подтверждают ассоциацию НАЖБП с ожирением и МС. По их данным, более чем у 90% пациентов с НАЖБП и ожирением выявляется хотя бы один из компонентов МС (критерии IDF, 2005). По мере увеличения числа компонентов МС вероятность наличия НАЖБП возрастает .
Инсулинорезистентность рассматривается как самостоятельный фактор, способный определить развитие и прогрессирование НАЖБП. НАЖБП встречается у 34-75% пациентов с различными нарушениями углеводного обмена, а при наличии НАЖБП инсулинорезистентность выявляется в 70-100% случаев. У пациентов с СД2 отмечена более высокая распространенность НАЖБП по сравнению с пациентами с СД1, что также свидетельствует о значении инсулинорезистентности в развитии НАЖБП .
Инсулинорезистентность приводит к развитию стеатоза печени через нарушение способности инсулина подавлять липолиз (преимущественно в висцеральных адипоцитах) и, таким образом, увеличению поступления свободных жирных кислот (СЖК) в печень. Избыточный приток СЖК способствует развитию и прогрессированию инсулинорезистентности в печени через активацию изоформы протеинкиназы С-дельта (PKC-6), приводящей к снижению фосфоинозитид-3 киназной активности, связанной с субстратом инсулинового рецептора I типа. Снижение чувствительности периферических тканей к инсулину и нарушение поступления глюкозы в клетки приводят к развитию гиперинсулинемии, повышению скорости липолиза в жировой ткани, поступлению увеличенного количества СЖК в печень, снижению скорости их окисления и усилению эстерификации, и, таким образом, избыточному образованию триглицери-дов в печени и развитию стеатоза .
В условиях гиперинсулинемии происходит инактивация транскрипционного фактора Foxa2, регулирующего окисление СЖК в печени. Поскольку фактор Foxa2 остается чувствительным к действию инсулина в печени в условиях инсулинорезистентности, гиперинсулинемия может приводить к его подавлению и нарушению метаболизма СЖК и, таким образом, способствовать развитию стеатоза печени . Системная гиперинсулинемия стимулирует липогенез de novo в печени через фактор транскрипции SREBP-1c. Экспрессия SREBP-lc в печени регулируется печеночным Х рецептором-a (LXR-a), индуцирующим синтез СЖК и транскрипцию SREBP-lc через ретиноидный рецептор Х-a (RXR-a), который повышает активность рецепторов, активирующих пролиферацию пероксисом-а (PPAR-а), являющихся регуляторами генов, вовлеченных в метаболизм липидов в печени и скелетных мышцах, а также гомеостаза глюкозы, что также может являться одним из механизмов, способствующих развитию стеатоза печени .
В развитии НАЖБП кроме инсулинорезистентности и гиперинсулинемии важную роль играет нарушение секреции адипоцитокинов. При ожирении секретируемые жировой тканью, преимущественно в избытке, адипоцитокины и медиаторы воспаления (лептин, фактор некроза опухолей альфа, адипонектин, интерлейкины-6, -8 и др.) могут способствовать развитию инсулинорезистентности, а также оказывать самостоятельное влияние на процессы ангио- и атерогенеза.
Лептин - многофункциональный гормон, секретируемый преимущественно адипоцитами белой жировой ткани, является продуктом экспрессии гена ожирения (ob гена); участвует в регуляции энергетического обмена и массы тела, влияет на процессы ангиогенеза, гемопоэза, фиброгенеза, воспаление, иммунные реакции. Лептин влияет на метаболизм липидов и обладает антистеатогенным действием, противодействующим эктопическому отложению липидов в периферических тканях .
При ожирении уровень лептина повышен, но в условиях лептинорезистентности, характерной для ожирения, не происходит усиления компенсаторного окисления жирных кислот, в ответ на их избыточное поступление в ткани, увеличивается образование триглицеридов и активируется перекисное окисление липидов. Накопление неокисленных метаболитов СЖК может приводить к развитию липотоксичности и, как следствие, метаболическим нарушениям. При нарушении действия лептина происходит также увеличение синтеза жирных кислот, независимо от их концентрации, de novo в печени вследствие гиперэкспрессии ряда протеинов, участвующих в нем .
В исследованиях продемонстрировано влияние лептина на процессы фиброгенеза в печени. Лептин обладает профиброгенным действием: способствует усилению выработки проколлагена I типа и трансформирующего фактора роста в (TGF- в), усиливает фагоцитарную активность и выработку цитокинов купферовскими клетками и макрофагами, стимулирует пролиферацию эндотелиоцитов и продукцию ими активных форм кислорода . В исследованиях на культурах клеток показано влияние лептина на процессы ангиогенеза в печени .
Таким образом, при ожирении лептин может быть одним из факторов развития стеатоза печени и его прогрессирования.
Адипонектин - белок, синтезируемый жировой тканью, выполняющий, в отличие от других адипоцитокинов, ряд протективных функций: противовоспалительную, противодиабетическую, ангио-и кардиопротективную. При ожирении и СД2 наблюдается снижение уровня адипонектина в крови, что может быть объяснено ассоциированным с ожирением воспалением. Провоспалительные маркеры, такие как фактор некроза опухолей альфа (ФНО-а), интерлейкин-6, снижают его экспрессию и секрецию в жировой ткани .
Адипонектин обладает различными эффектами: увеличивает окисление СЖК в печени путем активации АМФ-зависимой протеинкиназы и взаимодействия с рецепторами PPAR-a, повышает захват глюкозы в скелетных мышцах, сокращает продукцию глюкозы печенью, стимулирует секрецию инсулина, воздействует на чувствительность к инсулину как за счет прямой стимуляции фосфорилирования тирозина инсулинового рецептора I типа, так и опосредованно - через увеличение окисления СЖК в печени . По данным исследований, уровень адипонектина положительно коррелирует с чувствительностью периферических тканей к инсулину и отрицательно с инсулинорезистентностью .
Протективное действие адипонектина в отношении развития атеросклероза реализуется через подавление сосудистого воспаления, торможение адгезии моноцитов к эндотелию, блокирование трансформации макрофагов в пенистые клетки, снижение пролиферации гладкомышечных клеток сосудов и экспрессии молекул адгезии (VCAM-1, ICAM-1), Е-селектина, а также продукции ФНО-а макрофагами. Эти эффекты в комплексе и обуславливают его антиатерогенное действие .
В последние годы низкий уровень адипонектина многими исследователями рассматривается как один из предикторов развития СД2 и сердечно-сосудистых заболеваний (ССЗ). Ряд исследований показал ассоциацию уровня адипонектина с компонентами метаболического синдрома, а также его протективную роль в отношении развития стеатоза, стеатогепатита и их прогрессирования . У пациентов с НАЖБП и ожирением уровень адипонектина значительно ниже, чем у обследованных с аналогичным ИМТ без НАЖБП, и отрицательно коррелирует с содержанием жира в печени .
В развитии НАЖБП важную роль играют провоспалительные цитокины - интерлейкины-6 и -8 - и ФНО-а.
ФНО-а является многофункциональным провоспалительным цитокином, секретирующимся в основном макрофагами, преимущественно жировой ткани, и обладающим ауто- и паракринными эффектами. Многие исследователи рассматривают ФНО-а как медиатор инсулинорезистентности при ожирении . У пациентов с НАСГ обнаружена гиперэкспрессия мРНК ФНО-а не только в жировой ткани, но и печени, что проявляется более высокими плазменными концентрациями ФНО-а .
ФНО-а активирует ядерный транскрипционный фактор каппа В (NF-kB) в адипоцитах и гепатоцитах, что ведет к усилению фосфорилирования инсулинового рецептора I типа, нарушению связывания инсулина с рецептором, уменьшению активности ГЛЮТ4 и фосфоинозитол-3 киназы и, таким образом, снижению захвата и утилизации глюкозы клетками, нарастанию гипергликемии и развитию инсулинорезистентности. Активация NF-kB стимулирует также продукцию индуцибельной NO-синтазы (iNOS), способствуя развитию воспалительной реакции в сосудистой стенке, адгезии моноцитов к эндотелию и всего каскада оксидативного стресса. Под воздействием ФНО-а гладкомышечные и эндотелиальные клетки сосудов усиливают продукцию моноцитарного хемотаксического белка-1 (МСР-1), играющего важную роль в патогенезе атеросклероза . Также ФНО-а способствует повышению экспрессии и синтеза белка Bcl-2, активирующего апоп-тоз гепатоцитов .
Таким образом, ФНО-а оказывает многоплановое воздействие на метаболизм, ведущее к развитию целого ряда нарушений, ассоциированных с НАЖБП.
ИЛ-6, -8 - провоспалительные цитокины, продуцируемые жировой тканью, являются «гепатоцитактивирующими факторами» и могут индуцировать синтез провоспалительных белков, таких как фибриноген и С-реактивный белок. Уровни ИЛ-6, -8 в плазме отрицательно коррелируют с инсулинорезистентностью . У пациентов с НАСГ содержание интерлейкинов в плазме крови повышено .
Ингибитор активатора плазминогена-1 (ИАП-1) является сериновым ингибитором протеаз и основным регулятором фибринолитической системы. В норме синтез ИАП-1 происходит в основном в гепатоцитах и эндотелиальных клетках, в меньшей степени в тромбоцитах и мезотелиальных клетках. При ожирении жировая ткань сальника становится главным источником повышенного содержания ИАП-1 в организме. Кроме того, как показывают экспериментальные исследования, в условиях ожирения и повышенного содержания цитокинов (ФНО-a, ИЛ-1), экспрессия гена ИАП-1 повышается в культуре гладкомышечных, жировых и печеночных клеток . Повышенное содержание ИАП-1, наблюдаемое при ожирении, особенно абдоминальном, и НАЖБП, положительно коррелирует с метаболическими и антропометрическими параметрами: уровнями глюкозы, инсулина, триглицеридов, ХС ЛПНП и ИМТ . По данным исследований, высокий уровень ИАП-1 является независимым предиктором инфаркта миокарда и ССЗ .
Обобщающей моделью патогенеза НАЖБП в настоящее время является «теория двух ударов». Согласно этой теории, «первым ударом» является увеличение поступления свободных жирных кислот в печень. Накопление жира в гепатоцитах является следствием: повышенного поступления СЖК из жировой ткани; снижения скорости их окисления в митохондриях и избыточного синтеза СЖК из ацетилкоэнзима А. Увеличение притока СЖК и снижение скорости их окисления приводит к эстерификации СЖК с избыточным образованием триглицеридов в гепатоцитах и секреции повышенного количества липопротеидов очень низкой плотности (ЛПОНП), способствующих усилению свободнорадикального окисления липидов и накоплению продуктов их перекисного окисления («второй толчок») . В условиях повышенного поступления СЖК в печень возрастает роль микросомального окисления жирных кислот с участием цитохрома Р450 (CYP2E1 и CYP4A) и уменьшается Β-окисление СЖК в митохондриях, что приводит к образованию и накоплению реактивных форм кислорода, обладающих прямым цитотоксическим воздействием на гепатоциты и инициирующих процессы перекисного окисления липидов. На фоне нарастающей секреции провоспалительных цитокинов жировой тканью, в первую очередь ФНО-а, реактивные формы кислорода способствуют разобщению процесса окислительного фосфорилирования, истощению митохондриальной АТФ и, в конечном итоге, повреждению гепатоцитов и их некрозу .
Кроме того, продукты перекисного окисления липидов (альдегиды) при НАЖБП активируют звездчатые клетки печени, являющиеся основными продуцентами коллагена, а также индуцируют перекрестное связывание цитокератинов с формированием телец Мэллори и стимулируют хемотаксис нейтрофилов, что также способствует повреждению гепатоцитов и развитию стеатогепатита.
Многочисленные исследования подтверждают важность оксидативного стресса как критического патофизиологического механизма НАЖБП , способствующего развитию патологии эндотелия и, как следствие, сердечно-сосудистых заболеваний. Следовательно, избыток свободных радикалов и активация системы цитохрома P450, приводящие к хронической активации эндотелия, играют ведущую роль в развитии эндотелиальной дисфункции, разрушении липидов клеточных мембран, повреждении ДНК и других внутриклеточных белков гепатоцитов, и в последующем развитии фиброза и цирроза печени. Это подтверждают результаты исследований: в биоптатах печени пациентов с ожирением и НАЖБП - более высокие уровни пероксидации липидов, чем в норме .
В прогрессировании НАЖБП и развитии фиброза печени участвуют различные факторы роста, стимулирующие хроническое воспаление и фиброгенез путем усиления образования коллагена и соединительной ткани в печени: трансформирующий фактор роста-в (TGF-в), инсулиноподобный фактор роста (IGF-1), тромбоцитарный фактор роста (PDGF) .
В патогенезе НАЖБП могут принимать участие гены, участвующие в метаболизме глюкозы, липидов, воспалении и развитии фиброза .
Полиморфизм гена PNPLA3 (patatin-like phospholi-pase domain containing 3), кодирующего синтез белка адипонутрина, участвующего в транспорте СЖК, может способствовать повышению риска развития НАЖБП, независимо от наличия ожирения и СД. Его предположительное действие - снижение активности триацилглицеролгидролаз и увеличение концентрации триглицеридов, а также влияние на дифференцировку адипоцитов посредством активации PPAR-y .
Полиморфизм генов ENPP1/PC-1 Lys121GLN и IRS-1 Gly972Arg ассоциируется с повышением риска развития фиброза при НАЖБП .
В экспериментальных исследованиях показано, что полиморфизм гена MiRNA-10b, регулирующего накопление липидов и уровень триглицеридов, в культуре клеток подавляет синтез рецепторов PPAR-а, приводя к развитию стеатоза печени .
Полиморфизм 493 G/Т гена MTP, кодирующего белок-переносчик триглицеридов в ЛПОНП, также может ассоциироваться с развитием НАЖБП .
Таким образом, патогенез НАЖБП при ожирении сложный, в нем участвуют инсулинорезистентность, адипоцитокины, медиаторы воспаления и многие другие факторы. Индивидуальный вклад каждого из них в развитие НАЖБП и ее прогрессирование требует дальнейшего изучения.
Клинические проявления, классификация, диагностика и течение НАЖБП
Основными клинико-морфологическими формами НАЖБП являются: стеатоз, стеатогепатит, фиброз и цирроз печени.
НАЖБП, как правило, характеризуется бессимптомным течением, и наиболее часто заболевание выявляется случайно. Пациенты с жировой дистрофией не предъявляют жалоб или их жалобы неспецифичны: слабость, утомляемость, дискомфорт и тяжесть в правой подреберной области. По мере прогрессирования заболевания, как правило, на стадии цирроза печени, появляются симптомы, свидетельствующие о развитии печеночной недостаточности и портальной гипертензии: увеличение размеров живота, отеки, «печеночные» знаки, умеренная желтуха, повышенная кровоточивость.
Клинические симптомы НАЖБП неспецифичны и, в основном, не коррелируют с ее клиническими формами. В большинстве случаев НАЖБП диагностируют случайно при выявлении повышенных уровней печеночных трансаминаз, ультразвуковом исследовании печени или уже при появлении признаков портальной гипертензии.
При физикальном обследовании у 50-75% с НАЖБП больных обнаруживают гепатомегалию .
Лабораторная диагностика
У пациентов с НАЖБП показатели, характеризующие функциональное состояние печени (АЛТ, АСТ, гамма-глутамилтранспептидаза, щелочная фосфатаза), не определяют стадию и активность процесса. Повышенный уровень сывороточных трансаминаз выявляется лишь у 20-21% пациентов с НАЖБП. Тем не менее, нормальные показатели трансаминаз не исключают вероятность существования некротически-воспалительных изменений и фиброза печени. Вероятность наличия НАСГ выше при уровне трансаминаз, превышающем норму более чем в 2 раза. По данным исследований, при НАСГ уровень АЛТ чаще выше уровня АСТ, а пониженный уровень АЛТ в сочетании с выраженным ожирением может свидетельствовать о наличии тяжелого фиброза и цирроза печени . При развитии цирроза у больных НАЖБП могут выявляться: гипоальбуминемия, тромбоцитопения и увеличение времени свертывания крови.
В ряде случаев у пациентов с НАЖБП обнаруживаются нарушения метаболизма железа (повышение ферритина и насыщения трансферрина сыворотки), не связанные с наличием наследственного гемохроматоза.
Маркером НАЖБП может являться содержание в сыворотке крови фрагментов белка-филамента цитокератина-18 (CK18-Asp396), образующихся при его расщеплении активированными каспазами из гепатоцитов при апоптозе. Повышение уровней фрагментов цитокератина-18 является специфичным для стеатогепатита и позволяет дифференцировать его от стеатоза. Специфичность и чувствительность данного метода составляют 99,9% и 85,7% соответственно .
В последние годы для диагностики НАЖБП используются фибротесты, позволяющие оценить степень выраженности повреждения печени . Чувствительность и специфичность фибротестов составляют 70-90%. Их информативность возрастает с увеличением степени стеатоза, НАСГ и фиброза. Однако в связи с отсутствием в настоящее время достоверных данных по сопоставлению тестов с клинико-морфологическими изменениями в печени у пациентов с НАЖБП при пункционной биопсии, фибротесты не являются основным методом диагностики НАЖБП.
При НАЖБП также можно выявить различные составляющие МС: повышение уровня триглицеридов, снижение ХС ЛПВП в крови, различные нарушения углеводного обмена.
Инструментальные методы диагностики
К визуальным методам диагностики НАЖБП относят: ультразвуковое исследование, компьютерную и магнитно-резонансную томографию печени.
Ультразвуковое исследование печени у больных с НАЖБП, как правило, выявляет гиперэхогенность или диффузное увеличение «яркости» печеночной паренхимы (эхогенность печени превышает эхогенность почек), нечеткость сосудистого рисунка, дистальное затухание эхосигнала. Чувствительность и специфичность ультразвукового исследования составляет 60-94% и 88-95% соответственно и снижается по мере увеличения ИМТ и степени стеатоза до 49% и 75% .
По данным компьютерной томографии (КТ) печени, основными признаками НАЖБП являются: снижение рентгеноплотности на 3-5 HU (в норме рентгеноплотность печени меньше чем рентгеноплотность селезенки), более высокая плотность внутрипеченочных сосудов, воротной и нижней полой вен по сравнению с плотностью печеночной ткани. КТ печени позволяет лишь косвенно оценить стадию НАЖБП. Количественно оценить степень выраженности жировой инфильтрации в печени позволяет магнитно-резонансная томография с контрастированием. Очаги снижения интенсивности могут свидетельствовать о локальном накоплении жира в печени .
К неинвазивному методу диагностики НАЖБП относят эластографию (фиброскан), с помощью которой определяется плотность (фиброз) печени с помощью упругих волн. Данный метод не информативен при ИМТ более 30, то есть при ожирении, и не позволяет диагностировать стеатоз и стеатогепатит .
Таким образом, инструментальные методы диагностики НАЖБП обладают определенной диагностической информативностью в качественном определении стеатоза печени. Однако ни один из этих методов не позволяет точно определить стадию процесса, выявить стеатогепатит и определить степень его активности.
Морфологическая диагностика
В настоящее время «золотым стандартом» диагностики НАЖБП считается пункционная биопсия печени, позволяющая объективно диагностировать НАЖБП, оценить степень активности НАСГ, стадию фиброза, прогнозировать течение заболевания, контролировать эффективность лечения. По данным исследований, практическая значимость диагностики НАЖБП до проведения биопсии с использованием неинвазивных методов составляет всего 50% .
С 2005 года в клинической практике для комплексной оценки морфологических изменений в печени при НАЖБП широко используется шкала NAS (NAFLD activity score), предложенная D. A. Kleiner (табл. 1) . Шкала NAS включает следующие показатели: выраженность стеатоза, лобулярного воспаления и баллонной дистрофии гепатоцитов. Оценка проводится по баллам: сумма баллов 0-2 исключает диагноз НАСГ; 3-4 балла -пограничные значения, при которых наличие воспалительного поражения рассматривается индивидуально; 5-8 баллов с высокой вероятностью указывают на наличие НАСГ. Шкала NAS используется и для оценки эффективности лечения НАЖБП, поскольку позволяет достоверно определить динамику морфологических изменений на фоне терапии за относительно короткий период времени.
Биопсия печени сопровождается относительно малым риском развития осложнений (0,06-0,32%) и, как правило, проводится в амбулаторных условиях .
Течение и прогноз НАЖБП
Неалкогольная жировая болезнь печени, особенно на стадии стеатоза, характеризуется относительно доброкачественным, медленно прогрессирующим течением. Однако НАСГ во многих случаях остается своевременно нераспознанным и в отсутствие адекватного лечения в 50% прогрессирует и может приводить к развитию цирроза печени и фатальным последствиям. Как свидетельствуют исследования, в общей популяции у каждого третьего пациента с НАСГ отмечается его прогрессирование до стадии цирроза .
Наиболее значимыми факторами, способствующими развитию стеатоза печени и его прогрессированию в стеатогепатит с последующим развитием фиброза, а затем и цирроза печени, являются абдоминальное ожирение, гипертриглицеридемия и нарушения углеводного обмена .
Многие исследователи рассматривают стеатогепатит в качестве вероятной причины развития криптогенных циррозов печени неясной этиологии: по данным исследований, в 60-80% случаев криптогенный цирроз формируется в исходе НАСГ .
Результаты исследований, охватывающие 10-летний период наблюдения пациентов с НАСГ, свидетельствуют о прогрессировании фиброза печени и развитии цирроза за этот промежуток времени у 20—40%. В целом, по данным этих исследований, заболевание прогрессирует медленно, и прогноз зависит от стадии НАЖБП: наиболее благоприятный — при стеатозе, наихудший — при циррозе. В течение 4—10 лет наблюдения 9—26% пациентов умерли вследствие терминальной стадии цирроза .
В исследовании, проведенном в Швеции, было показано, что за 15 лет наблюдения за 129 пациентами с ожирением и морфологически доказанной НАЖБП, сопровождающейся хронической гипертрансаминаземией, 12,7% умерли от ССЗ и только 1,6% от печеночной патологии .
При циррозе печени, развившемся на фоне НАСГ, в 3% случаев возможно развитие гепатоцеллюлярной карциномы .
Лечение
Терапия НАЖБП направлена в первую очередь на факторы, способствующие ее развитию и прогрессированию, а также коррекцию ассоциированных метаболических нарушений. Поэтому основными задачами лечения пациентов с НАЖБП являются: уменьшение выраженности стеатоза и стеатогепатита печени, предотвращение прогрессирования заболевания до стадии цирроза и печеночно-клеточной недостаточности, а также снижение кардиометаболического риска .
Так как ожирение является наиболее значимым фактором, способствующим развитию НАЖБП, в первую очередь терапевтические мероприятия направлены на снижение массы тела. Снижение массы тела и особенно массы висцерального жира оказывают благоприятное воздействие на большинство метаболических нарушений, ассоциированных с ожирением.
Основу лечения пациентов с ожирением и НАЖБП составляют немедикаментозные методы: сбалансированное антиатерогенное питание с ограничением жиров до 25—30% от суточной калорийности, гипокалорийное (с умеренным дефицитом калорийности суточного рациона в 500—600 ккал) на этапе снижения веса и эукалорийное на этапе его поддержания, а также увеличение физической активности. Физическая активность является обязательной составляющей лечения. По данным исследований, при сочетании физических нагрузок с рациональным питанием наиболее значимо улучшаются показатели биохимических показателей и гистологических изменений при НАЖБП .
Показано благоприятное влияние физических нагрузок на инсулинорезистентность. Houmard J.A. с соавт. в своей работе зарегистрировали увеличение окисления жирных кислот и снижение инсулинорезистентности у пациентов с ожирением на фоне ежедневных аэробных физических нагрузок, даже при отсутствии снижения массы тела . Степень снижения инсулинорезистентности, как правило, коррелирует с интенсивностью физических упражнений, которые рекомендуется проводить ежедневно, продолжительностью 30—40 минут .
Постепенное уменьшение массы тела (на 0,5—1 кг в неделю) сопровождается положительной динамикой клинико-лабораторных показателей (уровней АЛТ, АСТ, ГГТ, глюкозы, липидов) и морфологической картины печени. Однако при быстром снижении массы тела может наблюдаться ухудшение гистологических изменений, характерных для НАЖБП, поэтому важным является постепенное снижение массы тела . Как показали исследования, на фоне быстрого снижения массы тела также возможно повышение уровня АЛТ, особенно у мужчин, а также у женщин с выраженным ожирением .
При неэффективности немедикаментозных методов лечения ожирения назначается фармакотерапия, направленная на снижение массы тела.
Безопасным и широко применяемым препаратом для лечения ожирения в настоящее время является орлистат (Ксеникал, «Ф. Хоффманн-Ля Рош Лтд.», Швейцария). Орлистат (тетрагидролипстатин) — специфический, длительно действующий ингибитор желудочно-кишечных липаз, снижающий расщепление и последующее всасывание жиров пищи примерно на 30%. Одновременно препарат уменьшает количество моноглицеридов и СЖК в просвете кишечника, что, в свою очередь, снижает растворимость и всасывание холестерина и способствует снижению его уровня в плазме крови. Орлистат обладает высокой селективностью в отношении ферментов желудочно-кишечного тракта, не оказывая влияния на всасывание углеводов, белков и фосфолипидов. Важным преимуществом препарата является его действие только в пределах желудочно-кишечного тракта и отсутствие системных эффектов.
Результаты проведенных в мире многочисленных плацебо контролируемых и других исследований (XENDOS, X-PERT, XXL и др.) подтверждают не только его эффективность в отношении снижения массы тела у пациентов с ожирением, но и его положительное влияние на уровень липидов крови, улучшение чувствительности к инсулину, снижение гиперинсулинемии . Доказана безопасность его применения в течение 4 лет .
Показано, что применение орлистата в течение года в комплексе с модификацией образа жизни (рациональное гипокалорийное питание, физические нагрузки) позволяет добиться клинически значимого снижения массы тела на 5% и более от исходной у 87% пациентов, и более 10% — до 51% пациентов .
Проведены клинические исследования, показывающие, что у пациентов с ожирением, принимающих орлистат, снижение массы тела, особенно массы висцеральной жировой ткани, оказывает благоприятное влияние на кардиометаболические факторы риска развития ССЗ и СД2 . Исследование XENDOS показало, что на фоне четырехлетнего приема орлистата у пациентов с нарушенной толерантностью к глюкозе риск развития СД2 снижается на 45% . Терапия орлистатом также приводит к значимому снижению уровней холестерина и триглицеридов у пациентов с ожирением . Улучшение липидного спектра крови на фоне приема орлистата достигается не только за счет снижения массы тела, но и прямого влияния препарата на всасывание холестерина в кишечнике.
При НАЖБП у пациентов с ожирением данные опубликованных исследований демонстрируют эффективность терапии орлистатом не только в отношении снижения массы тела, но и уменьшения стеатоза печени, уровней трансаминаз, липидов и показателей углеводного обмена .
В рандомизированном плацебо-контролируемом исследовании Zelber-Sagi S. и соавт. показали, что у пациентов, принимавших орлистат в сочетании с гипокалорийным питанием в течение 6 мес, орлистат превосходил плацебо по улучшению гистологических изменений в печени (уменьшение стеатоза) и снижению уровня АЛТ (более чем в 2 раза), что позволило авторам прийти к выводу, что терапия больных ожирением в сочетании с НАЖБП более эффективна при сочетании мероприятий по модификации образа жизни в комплексе с приемом орлистата .
В исследовании, проведенном Harrison S. и соавт., было продемонстрировано, что у пациентов, применявших орлистат в сочетании с приемом витамина Е 800 МЕ и гипокалорийным питанием и снизивших массу тела на 9% от исходной, произошло значительное (р<0,05) снижение уровня АЛТ в крови, уменьшение стеатоза печени, активности стеатогепатита и некроза гепатоцитов (по шкале активности НАЖБП NAS), однако выраженность фиброза не изменилась. Было также отмечено снижение инсулинорезистентности и повышение уровня адипонектина в крови. Увеличение уровня адипонектина коррелировало с улучшением гистологической картины печени .
Таким образом, показана эффективность лечения орлистатом у больных ожирением и НАЖБП, что благоприятно отражается на течении НАЖБП и ассоциированных факторах риска развития ССЗ и СД2.
Поскольку инсулинорезистентность играет ключевую роль в развитии и прогрессировании НАЖБП, обосновано применение фармакологических средств, оказывающих положительное воздействие на чувствительность тканей к инсулину - инсулиносенситайзеров. Наиболее изученным из этих препаратов является метформин.
Метформин не только напрямую воздействует на инсулинорезистентность, но и обладает целым рядом благоприятных метаболических эффектов. В печени метформин подавляет глюконеогенез и гликогенолиз, а также липолиз и окисление СЖК. В скелетных мышцах и жировой ткани препарат стимулирует тирозин-киназную активность инсулинового рецептора, активирует транспортер глюкозы ГЛЮТ4, способствует повышению поглощения, утилизации и окисления глюкозы, увеличивает чувствительность к инсулину. В жировой ткани препарат также подавляет липолиз и окисление СЖК. Метформин обладает выраженным антиатерогенным и кардиопротективным действием, замедляет всасывание углеводов в кишечнике и обладает слабым анорексигенным эффектом .
Данные многочисленных зарубежных и отечественных исследований свидетельствуют о положительном влиянии метформина на течение НАЖБП .
Опубликованы исследования, показывающие большее уменьшение размеров печени, по данным ультразвукового исследования, и улучшение гистологической картины НАЖБП (значительное уменьшение жировой инфильтрации, некровоспалительной активности, а также фибротических изменений печени) при применении метформина в дозе 1500-2000 мг в день в течение 1 года, в сравнении с пациентами, соблюдающими только диету . В исследовании С.А. Бутровой с соавт., у пациентов с МС и НАЖБП отмечено значимое снижение инсулинорезистентности, печеночных транс-аминаз в крови и улучшение метаболических показателей (глюкозы, липидов) на фоне терапии метформином в дозе 850 мг 2 раза в день в сочетании с гипокалорийным питанием в течение 6 мес . Nair.S. и соавт. показали, что применение метформина пациентами с НАЖБП в сочетании с рациональным питанием приводит к уменьшению инсулинорезистентности и значительному снижению уровней печеночных транс-аминаз в крови . Marchesini G. опубликовал результаты исследования, которое показало, что у пациентов с НАЖБП на фоне четырехмесячного лечения метформином улучшалась чувствительность к инсулину, снижались трансаминазы и уменьшались размеры печени .
В двойном слепом рандомизированном исследовании M. Tiikkainen и соавт. наблюдали снижение инсулинорезистентности в печени, уровня СЖК и гликированного гемоглобина в плазме крови при лечении метформином больных СД2 в течение 16 недель. Изменения уровней печеночных трансаминаз в крови и содержания жира в печени (по данным МРТ) авторы не отметили . На фоне терапии метформином у пациентов с НАЖБП в ряде исследований зарегистрировано увеличение содержания адипонектина в крови .
Ожирение и НАЖБП ассоциированы с хроническим воспалением и эндотелиальной дисфункций, являющимися факторами риска ССЗ. Данные многочисленных клинических и экспериментальных исследований подтверждают наличие у метформина провоспалительного и антиоксидантного эффектов, а также его способность уменьшать эндотелиальную дисфункцию, что в совокупности обуславливает его ангио- и кардиопротективное действие .
В исследовании с участием 457 больных с абдоминальным ожирением без СД2 показано положительное влияние метформина на процессы фибринолиза за счет снижения в плазме крови ИАП-1 и фактора Виллебрандта, повышения активности плазминогена и угнетения агрегации тромбоцитов. Применение метформина в комплексе с рациональным питанием сопровождалось снижением активности ИАП-1 на 30-40% .
Таким образом, представленные результаты исследований свидетельствуют об эффективности комбинированной терапии метформином в сочетании с рациональным питанием при лечении пациентов с ожирением и НАЖБП и ассоциированными кардио-метаболическими факторами риска.
Кроме метформина в литературе имеются сообщения об эффективности применения при НАЖБП агонистов рецепторов глюкагоноподобного пептида-1 (ГПП-1) и PPAR-y рецепторов .
Агонисты рецепторов ГПП-1 стимулируют секрецию инсулина, подавляют избыточную секрецию глюкагона, замедляют опорожнение желудка и вызывают чувство сытости, что в целом обеспечивает снижение массы тела.
В исследовании Tushuizen M.E. и соавт. показано снижение АЛТ и уменьшение стеатоза печени, по данным МРТ-спектроскопии, на фоне лечения эксенатидом в течение 44 недель .
Агонисты PPAR-y рецепторов (тиазолидиндионы) улучшают чувствительность к инсулину в основном за счет увеличения отложения СЖК в адипоцитах и, таким образом, снижения их уровня в крови и уменьшения негативного воздействия СЖК на печень. Тиазолидиндионы также стимулируют дифференцировку адипоцитов, увеличивают число мелких адипоцитов, обладающих высокой чувствительностью к действию инсулина, и подавляют глюконеогенез в печени.
В исследованиях показано положительное влияние тиазолидиндионов (розиглитазона и пиоглитазона) на течение НАЖБП. Так, назначение тиазолидиндионов пациентам с ожирением и НАЖБП улучшало гистологическую картину печени, уменьшало инсулинорезистентность, снижало уровни трансаминаз в крови .
Применение тиазолидиндионов может сопровождаться развитием нежелательных эффектов, таких как: задержка жидкости в организме, увеличение массы тела за счет накопления жира в подкожно-жировой клетчатке, умеренная анемия в результате увеличения объема циркулирующей крови, в связи с чем применение препаратов данной группы ограничено.
Имеется ряд работ по применению у больных с НАЖБП лекарственных средств с антиоксидантной активностью и гепатопротекторов, таких как эссенциальные фосфолипиды, бетаин, витамин Е, урсодезоксихолевая кислота .
Большое значение в лечении больных с ожирением и НАЖБП придается коррекции ассоциированных кардиометаболических нарушений . Поскольку НАЖБП, как правило, сочетается с нарушениями липидного обмена, особенно гипертриглицеридемией, больным проводится их коррекция с использованием статинов. Результаты исследований свидетельствуют об эффективности и безопасности применения статинов при НАЖБП, несмотря на то, что заболевания печени в активной фазе (в том числе сопровождаемые повышением трансаминаз) включены в перечень противопоказаний их назначению . По данным исследований, у больных, не зависимо от наличия ожирения и НАЖБП, повышение активности печеночных транс-аминаз на фоне приема статинов отмечается в 0,5-2% случаев, зависит от дозы препаратов и является преходящим . В исследовании N. Chalasani с соавт. показано, что у лиц с исходно повышенными уровнями печеночных трансаминаз (АСТ>40 Ед/л, АЛТ>35 Ед/л) прием статинов не вызывал их увеличения. Результаты исследования HPS (Heart Protection Study), в которое были включены 20 тыс. человек, длительно принимавших симвастатин, клинически значимое повышение активности печеночных трансаминаз отмечено лишь у 0,8% больных .
В заключение хотелось бы отметить, что неалкогольная жировая болезнь печени является довольно распространенной патологией, особенно среди лиц, страдающих ожирением; патогенетически ассоциирована с инсулинорезистентностью и метаболическими нарушениями, что увеличивает риск смертности из-за осложнений, преимущественно кардиоваскулярных, и отражается на качестве жизни пациентов. Растущая распространенность ожирения, НАЖБП и связанных с ними факторов риска развития СД2 и ССЗ, трудности диагностики и отсутствие общепринятого алгоритма ведения таких больных еще раз подтверждают актуальность данной проблемы. Дальнейшее изучение НАЖБП поможет разработать оптимальный алгоритм обследования и ведения больных с ожирением и НАЖБП на разных этапах развития заболевания, а также комплекс терапевтических мероприятий, направленных на лечение и предупреждение прогрессирования НАЖБП, коррекцию кардио-метаболических нарушений и факторов риска развития сердечно-сосудистых заболеваний и СД2.
Литература
- Буеверов А.О., Богомолов П.О., Маевская М.В. Патогенетическое лечение неалкогольного стеатогепатита: обоснование, эффективность, безопасность // Терапевтический архив. - 2007. - № 79(8). - С. 1-4.
- Бутрова С.А., Елисеева А.Ю., Ильин А.В. Эффективность метформина и больных с метаболическим синдромом и неалкогольной жировой болезнью печени // Ожирение и метаболизм. - 2008. - № 2(15). - С. 17-21.
- Ивашкин В.Т., Драпкина О.М., Буеверова Е.Л. Статины и неалкогольная жировая болезнь печени: безопасность применения // Российские Медицинские Вести. - 2010. - № XV(1). - С. 17-26.
- Ивашкин В.Т., Драпкина О.М., Шульпекова Ю.О. Диагностика и лечение неалкогольной жировой болезни печени / Методические рекомендации. М.: ООО «Издательский дом «М-Вести», 2009.
- Никитин И.Г. Скрининговая программа по выявлению распространенности неалкогольной жировой болезни печени и определению факторов риска развития заболевания // Российские Медицинские Вести. - 2010. - № XV(1). - С. 41-6.
- Павлов Ч.С., Ивашкин В.Т. Биопсия печени: методология и практика сегодня // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. - 2006. - № XVI(4). - С. 65-78.
- Adams L., Angulo P. Treatment of non-alcoholic fatty liver disease // Postgraduate medical Journal. - 2006. - № 82. - Р. 315-22.
- Alkhouri N., Dixon L., Feldstein A. Lipotoxicity in nonalcoholic fatty liver disease: not all lipids are created equal // Expert review of gastroenterology & hepatology. - 2009. - № 3(4). - Р. 445-51.
- Browning J.D., Horton J.D. Molecular mediators of hepatic steatosis and liver injury // J Clin Invest. - 2004. - № 114. - Р. 147-52.
- Browning J., Szczepaniak L., Dobbins R., et al. Prevalence of hepatic steatosis in an urban population in the United States: impact of ethnicity // Hepatology. - 2004. - № 40. - Р. 1387-95.
- Bugianesi E., Gentilcore E., Manini R., Natale S., Vanni E., Villanova N. A randomized controlled trial of metformin versus vitamin E or or prescriptive diet in nonalcoholic fatty liver disease // Am J Gastroenterol. - 2005. - № 100. - Р. 1082-90.
- Bugianesi E., Gastaldelli A., Vanni E., Gambino R., Cassader M., Baldi S., Ponti V., Pagano G., Ferrannini E., Rizzetto M. Insulin resistance in non-diabetic patients with non-alcoholic fatty liver disease: sites and mechanisms // Diabetogia. - 2005. - № 48. - Р. 634-42.
- Chavez-Tapia N., Barrientos-Gutierrez T., Tellez-Avila F., Sanchez-Avila F., Montano-Reyes M., Uribe M. Insulin sensitizers in treatment of nonalcoholic fatty liver disease: Systematic review // World J Gastroenterol. - 2006. - № 12(48). - Р. 7826-31.
- Charles M., Morange P., Eschwege E. Effect of weight change and metformin on fibrinolisis and the von Willebrand factor in obese nondiabetic subjects // Diabetes care. - 1998. - № 21. - Р. 1967-72.
- Cnop M., Havel P., Utzschneider K. Relationship of adiponectin to body fat distribution, insulin sensitivity and plasms lipoproteins: evidence for independent roles of age and sex // Diabetologia. - 2003. - № 46. - Р. 459-69.
- Dongiovanni P., Valenti L., R. Rametta., Daly A. K. et al. Genetic variants regulating insulin receptor signalling are associated with the severity of liver damage in patients with non-alcoholic fatty liver disease // Gut. - 2010. - № 59. - Р. 267-73.
- Ekstedt M., Franzen L., Mathiesen U. Statins in non-alcoholic fatty liver diseases and chronically elevated liver enzymes: a histopathological follow-up study // J hepatol. - 2007. - № 47(1). - Р. 135-41.
- Fassio E., Alvarez E., Dominguez N. Natural history of non-alcoholic steatohepatitis: a longitudinal study of liver biopsies // Hepatology. - 2004. - № 40. - Р. 820-6.
- Feldstein A., Charatcharoenwitthaya P., Treeprasertsuk S., Benson J., Enders F., Angulo P. The natural history of non-alcoholic fatty liver disease in children: a follow-up study for up to 20 years // Gut. - 2009. - № 58(11). - Р. 1538-44.
- Feldstein A.E., Wieckowska A.Е., Lopez A.R., Liu Y.C., Zein N.N., McCullough A.J. Cytokeratin-18 fragment levels as noninvasive biomarkers for nonalcoholic steatohepatitis: a multicenter validation study steatohepatitis // Hepatology. - 2004. - № 39(1). - Р. 188-96.
- Festi D., Colecchia A., Sacco T., Bondi M., Roda E., Marchesini G. Hepatic steatosis in obese patients: clinical aspects and prognostic significance // Obes Rev. - 2004. - № 5(1). - Р. 27-42.
- Ghany M., Premkumar A., Park Y., Liang T., Yanovski J., Kleiner D., Hoofnagle J. A pilot study of pioglitazone treatment for hepatitis // Hepatology. - 2009. - № 50(4). - Р. 564-8.
- Harrison S.A., Fecht W., Brunt E.M., Neuschwander-Tetri B.A. Orlistat for overweight subjects with nonalcoholic steatohepatitis: A randomized, prospective trial // Hepatology. - 2009. - № 49(1). - Р. 80-6.
- Hasegawa Т., Yoneda M., Nakamura K., Makino I., Terano A. Plasma trans¬forming growth factor-betal level and efficacy of alpha-tocopherol in patients with non-alcoholic steatohepatitis: a pilot study // Aliment. Pharmacol. Ther. - 2001. - № 15 (10). - Р. 1667-72.
- Houmard J.A., Tanner C.J., Slentz C.A. Effect of the volume and intensity of exercise training on insulin sensitivity // J Appl Physiol. - 2004. - № 96. - Р. 101-6.
- Hui J., Hodge A., Farrell G. Beyond insulin resistance in NASH: TNF-alpha or adiponectin? // Hepatology. - 2004. - № 40. - Р. 46-54.
- Kleiner D.E., Brunt E.M., Van Natta M., Behling C., Contos M.J., Cummings O.W., Ferrell L.D., Liu Y.C., Torbenson M.S., Unalp-Arida A., Yeh M., McCullough A.J., Sanyal A.J. Nonalcoholic Steatohepatitis Clinical Research Network. Design and validation of a histological scoring system for nonalcoholic fatty liver disease // Hepatology. - 2005 Jun. - № 41(6). - Р. 1313-21.
- Krempf M., Laville M., Basdevant A., et al. Effect of orlistat on NCEP ATP-IIIdefined metabolic syndrome in obese or overweight patients: meta-analysis from 20 randomised double-blind studies worldwide // Obese Rev. - 2005. - № 6(1). - Р. 166.
- Lazo M., Clark J. The epidemiology of nonalcoholic fatty liver disease: a global perspective // Semin Liver Dis. - 2008. - № 28(4). - Р. 339-50.
- Marchesini G., Brizi M., Morselli-Labate A., Bianchi G., Bugianesi E., McCullough A., Forlani G., Melchionda N. Association of nonalcoholic fatty liver disease with insulin resistance // Am. J. Med. - 1999. - № 107 (5). - Р. 450-5.
- Marchesini G., Bianchi G., Tomassetti S., Zoli M., Melchionda N. Metformin in non-alcoholic steatohepatitis // The Lancet. - 2001. - №). - Р. 893 - 4.
- Mazhar S., Shiehmorteza M., Sirlin C. Noninvasive assessment of hepatic steatosis // Clin Gastroenterol Hepatol. - 2009. - № 7(2). - Р. 135-40.
- Mehta R., Thomas E., Bell J., Johnston D., Taylor S. Non-invasive means of measuring hepatic fat content // World J Gastroenterol. - 2008. - № 14(22). - Р. 3476-83.
- Milner K., Van der Poorten D., Xu A., Bugianesi E., Kench J., Lam K., Chisholm D., George J. Adipocyte fatty acid binding protein levels relate to inflammation and fibrosis in nonalcoholic fatty liver disease // Hepatology. - 2009. - № 49(6). - Р. 1926-34.
- Mofrad P., Contos M., Haque M. Clinical and histologic spectrum of nonalcoholic fatty liver disease associated with normal ALT values // Hepatology. - 2003. - № 37. - Р. 1286-92.
- Musso G., Gambino R., Cassader M. Non-alcoholic fatty liver disease from pathogenesis to management: an update // Obesity Reviews. - 2010. - № 11(6). - Р. 430-45.
- Nair S., Diehl A., Wiseman M. Metformin in the triement of non- alcoholic steatohepatitis: a pilot open label trial // Aliment Pharmacol Ther. - 2004. - № 20. - Р. 23-8.
- Sabuncu T., Nazligui Y., Karaoglanoglu M. et al. The effects of sibutramine and orlistat on the ultrasonographic findings, insulin resistance and liver enzyme levels in obese patients with non-alcoholic steatohepatitis // Rom. J. Gastroentarol. - 2003. - № 12. - Р. 189-92.
- Schwenzer N., Springer F., Schraml C., Stefan N., Machann J., Schick F. Noninvasive assessment and quantification of liver steatosis by ultrasound, computed tomography and magnetic resonance // J Hepatol. - 2009. - № 51(3). - Р. 433-45.
- Stefan N., Kantartzis K., Häring H. Causes and Metabolic Consequences of Fatty Liver // Endocrine Reviews. - 2008. - № 29(7). - Р. 939-60.
- Targher G., Bertolini L., Scala L., Zoppini G., Zenari L., Falezza G. Non-alcoholic hepatic steatosis and its relation to increased plasma biomarkers of inflammation and endothelial dysfunction in non-diabetic men. Role of visceral adipose tissue // Diabet Med. - 2005. - № 22(10). - Р. 1354-8.
- Tiikkainen M., Hakkinen A., Korsheninnikova E. Effects of rosiglitazone and metformin on liver fat content, hepatic insulin resistance, insulin clearance, and gene expression in adipose tissue in patients with type 2 diabetes // Diabetes. - 2004. - № 53. - Р. 2169-76.
- Tilg H., Diehl A. Cytokines in alcoholic and nonalcoholic steatohepatitis // N Engl J Med. - 2000. - № 343(20). - Р. 1467-76.
- Tilg H., Diehl A., Li Z., Lin H., Yang S. Cytokines and the pathogenesis of nonalcoholic steatohepatitis // Gut. - 2005. - № 54. - Р. 303-6.
- Tobari M., Hashimoto E. Imaging of nonalcoholic steatohepatitis: advantages and pitfalls of ultrasonography and computed tomography // Intern Med. - 2009. - № 48(10). - Р. 739-46.
- Toplak H., Ziegler O., Keller U., et al. X-PERT: weight reduction with orlistat in obese subjects receiving a mildly or moderately reduced-energy diet: early response to treatment predicts weight maintenance // Diabetes Obes Metab. - 2005. - № 7(6). - Р. 699-708.
- Torer N., Ozenirler S., Yucel A., Bukan N., Erdem O. Importance of cytokines, oxidative stress and expression of BCL-2 in the pathogenesis of non-alcoholic steatohepatitis // Scandiavian Journal of Gastroenterology. - 2007. - № 42 (9). - Р. 1095-101.
- Torgerson J.S., Hauptman J., Boldrin M.N., et al. XENical in the prevention of Diabetes in Obese Subjects (XENDOS) study: a randomized study of orlistat as an adjunct to lifestyle changes for the prevention of type 2 diabetes in obese patients // Diabetes Care. - 2004. - № 27(1). - Р. 155-61.
- Tushuizen M.E., Bunck M.C., Pouwels P.J., et al. Incretin mimetics as a novel therapeutic option for hepatic steatosis // Liver Int. - 2006. - № 26. - Р. 1015-7.
- Utzschneider K.M., Kahn S.E. The Role of Insulin Resistance in Nonalcoholic Fatty Liver Disease // The Journal of Clinical Endocrinology & Metabolism. - 2006. - № 91(12). - Р. 4753-61.
- Uygun A., Kadayifci A., Isik A.T., Ozgurtas T., Deveci S., Tuzun A., Yesilova Z., Gulsen M., Dagalp K. Metformin in the treatment of patients with non-alcoholic steatohepatitis // Aliment Pharmacol Ther. - 2004. - № 19(5). - Р. 537-44.
- Webb M., Yeshua H., Zelber-Sagi S., Santo E., Brazowski E., Halpern Z., Oren R. Diagnostic Value of a Computerized Hepatorenal Index for Sonographic Quantification of Liver Steatosis // AJR. - 2009. - № 192. - Р. 909-14.
- Wirth A. Reduction of body weight and co-morbidities by orlistat: The XXL-Primary Health Care Trial // Diabetes Obes Metab. - 2005. - № 7(1). - Р. 21-7.
- Zelber-Sagi S., Kessler A., Brazowsky E., et al. A double-blind randomized placebocontrolled trial of orlistat for the treatment of nonalcoholic fatty liver disease // Clin Gastroenterol Hepatol. - 2006. - № 4. - Р. 639-44.
- Zheng L., Lv G., Sheng J., Yang Y. Effect of miRNA-10b in regulating cellular steatosis level by targeting PPAR-α expression, a novel mechanism for the pathogenesis of NAFLD // J. Gastroenterol. Hepatol. - 2010. - № 25(1). - Р. 156-63.
В настоящее время неалкогольная жировая болезнь печени (НЖБП) является одним из самых распространенных заболеваний в гепатологии, приводящим к ухудшению качества жизни, инвалидизации и смерти. В первую очередь, это обусловлено высоким риском прогрессирования НЖБП с развитием неалкогольного стеатогепатита (НАСГ), печеночной недостаточности и гепатоцеллюлярной карциномы. Общая распространенность НЖБП в популяции колеблется от 10 до 40%, тогда как частота НАСГ составляет 2-4% .
Эпидемиология и патогенез НЖБП
Понятие НЖБП объединяет спектр клинико-морфологических изменений печени, представленных стеатозом, НАСГ, фиброзом и циррозом, развивающихся у пациентов, не употребляющих алкоголь в гепатотоксичных дозах (не более 40 г этанола в сутки для мужчин и не более 20 г — для женщин). НЖБП встречается во всех возрастных группах, но наибольшему риску ее развития подвержены женщины в возрасте 40-60 лет с признаками метаболического синдрома (МС) .
Патогенез НЖБП тесно связан с синдромом инсулинорезистентности (ИР), вследствие которого в печени накапливаются триглицериды (ТГ) и формируется жировой гепатоз (ЖГ) — первый этап или «толчок» заболевания. В последующем происходит высвобождение из жировой ткани и синтез de novo в гепатоцитах свободных жирных кислот (СЖК), способствующих возникновению окислительного стресса, являющегося вторым «толчком» заболевания и приводящего к развитию воспалительно-деструктивных изменений в печени в виде стеатогепатита .
Максимальный риск развития НЖБП отмечен в группе лиц с МС — это пациенты с сахарным диабетом (СД) 2 типа, ожирением, гипертриглицеридемией. Частота НЖБП у больных СД 2 типа и ожирением по данным различных исследований варьирует от 70 до 100%. При этом СД 2 типа или нарушение толерантности к глюкозе (НТГ) отмечаются у 10-75%, ожирение — у 30-100%, гипертриглицеридемия — у 20-92% пациентов с НЖБП . В то же время признаки НЖБП обнаруживаются у 10-15% людей без клинических проявлений МС, что может быть обусловлено другими патогенетическими механизмами формирования НЖБП, например, синдромом избыточной пролиферации бактерий в кишечнике или дисбиозом, как это принято формулировать в отечественной литературе .
Основные механизмы развития НЖБП при кишечном дисбиозе связаны с нарушением синтеза апо-липопротеидов классов А и С, являющихся транспортной формой для ТГ в процессе образования липопротеидов очень низкой плотности (ЛПОНП), а также кишечным эндотоксикозом, что позволяет рассматривать это состояние в качестве дополнительного источника окислительного стресса (рис.) .
Взаимосвязь патогенеза НЖБП с ИР позволяет считать это заболевание одним из независимых компонентов МС, клиническая значимость которого заключается в значительном прогрессировании атеросклеротического поражения сосудов.
В ряде работ показано, что НЖБП повышает риск возникновения сердечно-сосудистых заболеваний (ССЗ) независимо от других предикторов и проявлений МС . Это подтверждается несколькими фактами, к которым относится связь НЖБП с концентрацией адипонектина в плазме. Известно, что адипонектин обладает антиатерогенным действием и по данным многих проспективных исследований снижение его уровня является ранним предиктором ССЗ и МС. У пациентов с НЖБП была отмечена более низкая концентрация адипонектина в плазме, чем у здоровых лиц .
Кроме этого, у указанной категории больных по сравнению с контрольной группой отмечается значительное увеличение толщины интимы (ТИ) сонной артерии, которое также признано достоверным субклиническим признаком атеросклероза. Доказано, что величина ТИ менее 0,86 мм связана с низким риском ССЗ, а более 1,1 — с высоким. У пациентов с НЖБП ее значение составляет в среднем 1,14 мм .
Другим субклиническим признаком атеросклероза, обнаруженным у больных НЖБП, служит выявление эндотелиальной дисфункции, что подтверждается снижением эндотелийзависимой вазодилатации плечевой артерии у пациентов с НЖБП. При этом уменьшение этого показателя коррелирует со степенью морфологических изменений в печени независимо от пола, возраста, ИР и других компонентов МС .
Таким образом, патогенез НЖБП неразрывно связан с МС, а сам факт развития указанной патологии изменяет прогноз для этих пациентов, как в виде прогрессирования печеночной недостаточности, так и в виде значительного увеличения частоты осложнений ССЗ.
Клиника и диагностика
В целом для НЖБП характерно бессимптомное течение, поэтому наиболее часто в практике врач сталкивается со случайно обнаруженным при биохимическом исследовании синдромом цитолиза. При этом пациент с НЖБП, как правило, либо не предъявляет жалоб, либо они являются неспецифичными в виде астеновегетативного синдрома (слабость, утомляемость) и дискомфорта в правом подреберье. Наличие кожного зуда, диспепсического синдрома, наряду с развитием желтухи и портальной гипертензии, свидетельствует о далеко зашедшей стадии НЖБП .
При объективном осмотре больных НЖБП обращают на себя внимание гепатомегалия, которая встречается у 50-75%, и спленомегалия, выявляемая у 25% пациентов .
При лабораторном исследовании для НЖБП характерны следующие изменения:
Повышение активности аланиновой (АЛТ) и аспарагиновой (АСТ) аминотрансфераз не более чем в 4-5 раз, индекс АСТ/АЛТ не более 2, чаще повышена активность АЛТ;
Повышение активности щелочной фосфатазы (ЩФ) и g-глутамилтранспептидазы (ГГТП);
Гипертриглицеридемия, гиперхолестеринемия;
Гипергликемия (НТГ или СД 2 типа);
Гипоальбуминемия, повышение уровня билирубина, тромбоцитопения, увеличение протромбинового времени у пациентов с далеко зашедшей стадией НЖБП .
Основным дифференциальным отличием ЖГ от НАСГ, доступным в клинической практике, может быть выраженность биохимического синдрома цитолиза.
Следует отметить, однако, что отсутствие изменений лабораторных показателей, характеризующих функциональное состояние печени (АЛТ, АСТ, ЩФ, ГГТП), не исключает наличия воспалительно-деструктивного процесса и фиброза .
Как указывалось выше, диагностический поиск проводится в связи с выявлением у больного синдрома цитолиза, при этом наличие у него СД 2 типа, абдоминального ожирения, артериальной гипертензии и нарушения липидного обмена свидетельствует о высокой вероятности НЖБП. Постановка этого диагноза достаточно сложна ввиду необходимости исключения всех других причин, вызывающих цитолиз, макровезикулярный стеатоз и воспалительно-деструктивные изменения в печени. Следует исключить вторичный характер поражения печени (табл. 1) .

Для уточнения диагноза могут использоваться инструментальные методы (ультразвуковое исследование (УЗИ), компьютерная томография (КТ), магнитно-резонансная томография (МРТ)), которые позволяют верифицировать гепатомегалию, косвенно оценить степень стеатоза печени и зарегистрировать формирование портальной гипертензии.
УЗИ является недорогим и, по мнению некоторых авторов, достаточно информативным инструментальным методом диагностики стеатоза печени. Выделяют 4 основных ультразвуковых признака стеатоза печени:
Дистальное затухание эхосигнала;
Диффузная гиперэхогенность печени («яркая печень»);
Увеличение эхогенности печени по сравнению с почками;
Нечеткость сосудистого рисунка .
К преимуществам УЗИ относится также возможность регистрировать динамику признаков стеатоза, в том числе на фоне лечения .
При проведении КТ печени основными признаками, свидетельствующими о наличии стеатоза, являются:
Снижение рентгеноплотности печени, которая в норме составляет 50-75 единиц, до 3-5 единиц (при выполнении КТ без контрастного внутривенного усиления плотность печеночной ткани при стеатозе снижается примерно на 1,6 единицы на каждый миллиграмм ТГ, содержащихся в одном грамме печеночной ткани);
Рентгеноплотность печени при стеатозе меньше рентгеноплотности селезенки;
Визуализация внутрипеченочных сосудов, воротной и нижней полой вен как более плотных структур по сравнению с печеночной тканью;
Пересечение нормальными кровеносными сосудами печени зон пониженной рентгеноконтрастности (характерно для очаговой жировой дистрофии) .
В целом КТ менее информативна, чем УЗИ при диффузных поражениях печени, однако она является методом выбора при очаговых заболеваниях .
Преимуществами современной высокопольной МРТ по сравнению с другими методами визуализации являются: высокая тканевая контрастность изображения за счет выгодного соотношения сигнал-шум, возможность получения целостного изображения органа в любой проекции, а также большие ресурсы программного обеспечения, используемые для дифференциальной диагностики.
Однако все визуализационные методы диагностики, несмотря на достаточно высокую информативность, не позволяют оценить наличие признаков стеатогепатита, степень его активности и стадию фиброзных изменений в печени . Поэтому с целью верификации диагноза необходимо проведение пункционной биопсии.
Значение пункционной биопсии печени в клинической практике неоднозначно. С одной стороны, только биопсия печени позволяет провести дифференциальный диагноз между стеатозом и стеатогепатитом, оценить стадию фиброза и на основании гистологических данных прогнозировать дальнейшее течение заболевания, а также исключить другие причины поражения печени. Однако отсутствие информированности врачей о целесообразности, а пациентов о безопасности метода сдерживают активное внедрение пункционной биопсии в практику.
Помимо этого, до сих пор активно обсуждаются морфологические критерии НЖБП. До настоящего времени в практике широко использовалась классификация, предложенная Brunt Е. (1999, 2001), которая подразделяет НЖБП в зависимости от степеней стеатоза, активности воспаления и стадии фиброза печени:
I. Степени крупнокапельного стеатоза:
0 степень: нет стеатоза;
1 степень: стеатоз до 33% гепатоцитов;
2 степень: стеатоз 33-66% гепатоцитов;
3 степень: стеатоз более 66%.
II. Степени НАСГ:
1 степень (мягкий НАСГ) — стеатоз 1-2 степени, минимальная баллонная дистрофия в 3 зоне ацинуса, лобулярное воспаление — рассеянная или минимальная лимфоплазмоцитарная инфильтрация, портальное воспаление отсутствует или минимальное;
2 степень (умеренный НАСГ) — стеатоз любой степени (крупно- и мелкокапельный), умеренная баллонная дистрофия в 3 зоне ацинуса, мягкое или умеренное портальное и лобулярное воспаление в 3 зоне ацинуса, может быть перисинусоидальный фиброз;
3 степень НАСГ (тяжелый НАСГ) — панацинарный стеатоз (смешанный), выраженная баллонная дистрофия, выраженное лобулярное воспаление, мягкое или умеренное портальное воспаление.
III. Стадии фиброза:
1 стадия — перисинусоидальный/перицеллюлярный фиброз в 3 зоне ацинуса, очаговый или распространенный;
2 стадия — перисинусоидальный/перицеллюлярный фиброз в 3 зоне ацинуса, очаговый или распространенный перипортальный фиброз;
3 стадия — очаговый или распространенный мостовидный фиброз;
4 стадия — цирроз печени .
Однако, по мнению ряда авторов, эта классификация не отражает целый спектр морфологических признаков, выявляемых у больных НЖБП при гистологическом исследовании. Недавно на основе существующей классификации была разработана и предложена Шкала активности НЖБП (NAFLD activity score — NAS), представляющая комплексную оценку морфологических изменений в баллах и объединяющая такие критерии, как стеатоз (0-3), лобулярное воспаление (0-2) и баллонную дистрофию гепатоцитов (0-2). Сумма баллов менее 3 позволяет исключить НАСГ, а более 5 свидетельствует о наличии у пациента гепатита. Данная шкала используется преимущественно для оценки эффективности лечения НЖБП, поскольку позволяет определить достоверность динамики морфологических изменений на фоне терапии за относительно короткий период времени .
В тех случаях, когда выполнение пункционной биопсии невозможно, диагноз НЖБП устанавливается в соответствии с алгоритмом, позволяющим пошагово исключить другие заболевания печени (табл. 2).
В связи с тем, что все пациенты с МС относятся к группе риска развития НЖБП, то больные с ожирением, СД 2 типа или НТГ, нарушением липидного обмена нуждаются в дополнительном обследовании, включающем клинические, лабораторные и инструментальные методы диагностики НЖБП и, в особенности, НАСГ. Однако до настоящего времени НЖБП и ее проявления не входят ни в критерии постановки диагноза МС, ни в алгоритм обследования больных с подозрением на его наличие (табл. 3).
Скрининг больных на стадии доклинических проявлений МС включает:
Анамнез (наследственность, образ жизни, пищевые привычки, физические нагрузки);
Антропометрические измерения (индекс массы тела (ИМТ), объем талии (ОТ) и бедер (ОБ), индекс ОТ/ОБ);
Мониторинг артериального давления (АД), электрокардиографическое исследование;
Оценку липидограммы (ТГ, общего холестерина, холестерина липопротеидов высокой и низкой плотности (ХС ЛПВП, ХС ЛПНП), апо-В плазмы);
Определение уровня глюкозы натощак, глюкозотолерантный тест по показаниям;
Инсулин крови натощак.
С учетом частоты, роли и значения НЖБП, в алгоритм обследования больных с МС должны входить клинико-лабораторные и инструментальные методы, позволяющие оценить морфофункциональное состояние печени:
Объективный осмотр (оценка гепатомегалии, спленомегалии, выявление телеангиоэктазий, пальмарной эритемы и т. д.);
Клинический анализ крови (наличие тромбоцитопении, анемии);
Оценка биохимических показателей, отражающих функциональное состояние печени (АЛТ, АСТ, ГГТП, ЩФ, общий билирубин, протромбин, протеинограмма);
УЗИ печени (степень стеатоза, гепатомегалия, портальная гипертензия);
Фиброгастродуоденоскопия (скрининг варикозно-расширенных вен пищевода);
КТ, МРТ, радиоизотопное сканирование печени;
Пункционная биопсия печени.
Обязательными показаниями для биопсии являются:
Возраст старше 45 лет и хронический цитолиз неустановленной этиологии;
Сочетание хронического цитолиза неустановленной этиологии по крайней мере с двумя проявлениями МС, независимо от возраста.
Оценивать течение НЖБП возможно на основании данных гистологического исследования печени. Однако когда выполнение биопсии недоступно, существуют предикторы, позволяющие предположить высокий риск прогрессирования НЖБП с развитием гепатита и фиброза, которые были установлены при проведении статистической обработки результатов большого количества наблюдений .
К ним относятся:
Возраст старше 45 лет;
Женский пол;
ИМТ более 28 кг/м 2 ;
Увеличение активности АЛТ в 2 раза и более;
Уровень ТГ более 1,7 ммоль/л;
Наличие артериальной гипертензии;
СД 2 типа;
Индекс ИР (НОМА-IR) более 5.
Выявление более 2 критериев свидетельствует о высоком риске фиброза печени.
Для формулировки полноценного клинического диагноза необходимо учитывать данные клинико-лабораторного и инструментального обследования, выявление факторов неблагоприятного течения заболевания и других компонентов МС. Поскольку диагноз «неалкогольная жировая болезнь печени» в МКБ-10 (ВОЗ, 1998) пока отсутствует, его формулировка практическими врачами может производиться с учетом правил диагностики алкогольной болезни печени и вирусных гепатитов. В диагнозе на первом месте лучше указывать ту нозологическую единицу, на фоне которой развилась НЖБП, далее идет форма заболевания (гепатоз или НАСГ), степень стеатоза (по данным УЗИ), активность гепатита и стадия фиброзных изменений в печени в случае проведения гепатобиопсии. Если морфологическое исследование не выполнялось, допустимым, как и при других заболеваниях печени, является заключение: неустановленный фиброз. Примеры диагностических заключений:
Ожирение II степени. Неалкогольная жировая болезнь печени: стеатоз II степени (по УЗИ), неустановленный фиброз (биопсия не проводилась).
Гипертоническая болезнь II стадии. Артериальная гипертензия I степени, риск высокий. Вторичная дислипопротеидемия, комбинированная. Сахарный диабет, впервые выявленный. Ожирение I степени. Неалкогольная жировая болезнь печени: неалкогольный стеатогепатит, умеренная активность, 2 стадия фиброзных изменений (перипортальный фиброз).
Сахарный диабет 2 типа, компенсированный. Неалкогольная жировая болезнь печени: неалкогольный стеатогепатит, выраженная активность (тяжелое течение), выраженный (мостовидный) фиброз.
Сахарный диабет 2 типа, декомпенсированный. Цирроз печени в исходе тяжелого неалкогольного стеатогепатита, субкомпенсированный, класс В по Чайлд, выраженная портальная гипертензия, асцит, варикозное расширение вен пищевода II степени.
Лечение НЖБП
В связи с высокой вероятностью неблагоприятного течения НЖБП, особенно в сочетании с другими проявлениями МС, все больные независимо от тяжести заболевания нуждаются в динамическом наблюдении и лечении. Однако до сих пор не разработаны стандартизированные терапевтические подходы к ведению пациентов с НЖБП.
Используемые направления терапии больных НЖБП основываются на механизмах развития заболевания, к которым в первую очередь относятся синдром ИР и окислительный стресс, поэтому наиболее важными задачами у данной категории пациентов являются:
- коррекция метаболических нарушений:
Снижение массы тела (диета и физические нагрузки);
Повышение чувствительности клеточных рецепторов к инсулину (метформин, тиазолидиндионы);
Снижение уровня ТГ (фибраты, статины);
Снижение концентрации TNFa (пентоксифиллин);
Гипотензивная терапия (антагонисты рецепторов ангиотензина II);
Антиоксиданты и гепатопротекторы (витамин Е, силибинин, бетаин, N-ацетилцистеин, урсодеоксихолевая кислота (УДК), a-липоевая кислота (АЛК));
Диета. С учетом современных представлений об этиологии, патогенезе и факторах прогрессирования НЖБП больным рекомендуются следующие диетические принципы:
Для пациентов с избыточной массой тела и ожирением — снижение общей энергетической ценности пищевого рациона. Суточная калорийность подбирается индивидуально в зависимости от массы тела, возраста, пола, уровня физической активности с использованием специальных формул. Сначала рассчитывают количество калорий, необходимых для основного обмена:
для женщин:
18-30 лет: (0,06 × вес в кг + 2,037) × 240
31-60 лет: (0,034 × вес в кг + 3,54) × 240
старше 60 лет: (0,04 × вес в кг + 2,76) × 240
для мужчин:
18-30 лет: (0,06 × вес в кг + 2,9) × 240
31-60 лет: (0,05 × вес в кг + 3,65) × 240
старше 60 лет: (0,05 × вес в кг + 2,46) × 240.
Полученное значение умножают на коэффициент физической активности (1,1 — низкая активность, 1,3 — умеренная, 1,5 — тяжелая физическая работа или активное занятие спортом) и получают калорийность суточного рациона. Для снижения массы тела из рассчитанной величины суточных энергозатрат вычитают 500-700 ккал. Однако минимальное потребление калорий в сутки должно быть не менее 1200 ккал для женщин и не менее 1500 для мужчин. Доказано, что снижение массы тела на 5-10% сопровождается уменьшением гепатоспленомегалии, активности АЛТ, АСТ и коррелирует с регрессированием стеатоза печени . Следует учесть, что быстрая потеря веса может привести к развитию «острого» НАСГ с формированием портального фиброза, центральных некрозов на фоне значительного повышения воспалительной активности вследствие увеличения поступления СЖК в печень на фоне периферического липолиза . Для больных ожирением и НЖБП безопасным и эффективным является снижение массы тела на 500 г в неделю для детей и на 1600 г в неделю для взрослых .
Ограничение жиров до 25-30% от общей энергетической ценности пищи;
Соотношение полиненасыщенных и насыщенных жирных кислот (ЖК) в пище более 1 (исключение сливочного масла, животного жира, твердых сортов маргарина и пр., употребление продуктов, богатых полиненасыщенными ЖК, — растительное масло, морепродукты, рыба, птица, маслины, орехи с учетом энергетической потребности);
Уменьшение потребления продуктов с высоким содержанием холестерина (не более 300 мг в сутки) — исключение субпродуктов (печени, почек), икры, яичного желтка, сырокопченых колбас, жирных сортов мясных и молочных продуктов;
Исключение продуктов, приготовленных в результате такой обработки пищи, как жарка, фритюр и т. д.;
Обогащение пищи витаминами и естественными пребиотиками (фрукты, топинамбур, лук-порей, артишоки);
Для больных с НТГ и СД 2 типа актуальна диета с исключением простых и ограничением сложных углеводов, что способствует достижению метаболического контроля.
Повышение чувствительности клеточных рецепторов к инсулину . К базисным медикаментозным средствам лечения синдрома ИР у больных НЖБП могут быть отнесены инсулиновые сенситайзеры — бигуаниды (метформин) и тиазолидиндионы (пиоглитазон, росиглитазон) — препараты, повышающие чувствительность клеточных рецепторов к инсулину. Опыт применения данных лекарственных средств свидетельствует о положительном влиянии на клинико-морфологические проявления НЖБП в виде уменьшения активности показателей цитолитического синдрома, степени стеатоза и воспаления. Но в целом вопрос применения этих препаратов у больных НЖБП требует проведения дальнейших исследований, что обусловлено отсутствием адекватных методов контроля эффективности лечения (гепатобиопсия) в выполненных работах .
Гиполипидемические средства . Учитывая патогенез заболевания, у пациентов с НЖБП эффективным может оказаться применение гиполипидемических средств из группы фибратов. Однако результаты исследования с назначением клофибрата больным НЖБП показали его неэффективность . Не следует забывать и о возможности развития фибрат-индуцированных гепатитов. В отношении статинов также существует ряд противопоказаний, связанных с их гепатотоксическим действием. В целом данные выполненных работ противоречивы и указывают на необходимость дальнейшего изучения возможности использования этих препаратов у пациентов с НЖБП.
Пентоксифиллин. Снижение концентрации тумор-некротизирующего фактора-a (TNFa) имеет значение для прогрессирования НЖБП. Обладая высокой биологической активностью, TNFa усиливает ИР и приводит к развитию окислительного стресса. Уменьшение его уровня в крови связано с регрессом клинических и морфологических проявлений НЖБП. Подобный эффект был обнаружен у пентоксифиллина. Назначение этого препарата у пациентов с НАСГ в суточной дозе 1200 мг на протяжении 12 месяцев было связано со снижением показателей цитолитического синдрома и достоверным улучшением гистологических показателей у 67% больных .
Антагонисты рецепторов ангиотензина II. Формирование данного подхода обусловлено ролью ангиотензина в прогрессировании НАСГ. Установлено, что он, способствуя пролиферации миофибробластов, клеточной миграции, синтезу коллагена и провоспалительных цитокинов, активирует процессы фиброгенеза в печени. Поэтому в настоящее время исследуется возможность применения блокаторов ангиотензиновых рецепторов у пациентов с НЖБП. Так, прием лозартана у пациентов с НАСГ и артериальной гипертензией в суточной дозе 50 мг в течение 38 недель приводил к достоверному снижению АЛТ и ГГТП, что сочеталось с уменьшением степени стеатоза и воспалительной активности .
Антиоксиданты. Применение антиоксидантов у больных НЖБП оправдано наличием окислительного стресса, что подтверждается повышением в плазме у больных НАСГ маркера окислительного стресса — тиоредоксина и снижением концентрации антиоксидантных факторов. В настоящее время активно изучается возможность использования витамина Е, эффективность которого была продемонстрирована в ряде исследований . Также имеется ряд зарубежных и отечественных работ, посвященных оценке влияния УДК на морфофункциональное состояние печени. Механизмы действия этой гидрофильной кислоты связаны с тем, что, нормализуя гепатоэнтеральную циркуляцию желчных кислот и целого ряда биологически активных веществ, вытесняя токсичные желчные кислоты, она способствует ликвидации избытка холестерина в гепатоцитах, путем уменьшения его синтеза и всасывания из кишечника. УДК также обладает цитопротективным и антиапоптотическим действием, препятствуя развитию окислительного стресса, что позволяет применять ее на обоих этапах НЖБП .
В отношении АЛК установлено, что она обладает плейотропным действием на весь организм, оказывая положительное влияние на энергетический, липидный (тормозит синтез холестерина, подавляя высвобождение СЖК из жировой ткани, что предупреждает развитие стеатоза гепатоцитов) и углеводный (снижает ИР, усиливает захват и утилизацию глюкозы клеткой, повышает чувствительность клеточных рецепторов к инсулину) виды обменов.
Кроме этого, АЛК, имея низкий оксислительно-восстановительный потенциал, обладает мощным антиоксидантным эффектом, действуя непосредственно на печень, способствует повышению детоксицирующих субстанций в гепатоцитах (восстанавливает глутатион) и улучшению морфологических изменений .
Восстановление микробиоценоза кишечника. К сожалению, большинство работ, подтверждающих патогенетическую роль дисбиоза кишечника в формировании НЖБП и эффективность антибактериальных препаратов в лечении указанной нозологии, относится к 80-90-м годам прошлого столетия.
Поэтому вопрос проведения санации кишечника антибактериальными препаратами остается открытым. Антибиотики рекомендуются только при наличии верифицированной чувствительной условно-патогенной флоры в кишечнике или формировании заболевания после оперативного лечения на брюшной полости, например «синдрома приводящей петли». Преимуществом выбора при этом принадлежит препаратам, обладающим способностью хорошо накапливаться в желчи с эффектом вторичного прохождения через желудочно-кишечный тракт, к которым относятся фторхинолоны первого поколения (ципрофлоксацин). Также могут использоваться кишечные антисептики, типа метронидазола или нифуроксазид, и невсасывающиеся в кишечнике препараты, например рифаксимин.
Во всех остальных случаях, когда нет показаний для применения антибиотиков, кишечную санацию у больных НЖБП следует проводить пребиотиками, а препаратом выбора в данном случае является Эубикор. Его преимуществом является сбалансированный состав, куда входят пищевые волокна и винные дрожжи (S. vini ). Кроме мощного пребиотического эффекта, Эубикор обладает хорошими сорбционными свойствами, что позволяет не только восстанавливать нормальную микрофлору, но и проводить дезинтоксикацию. По результатам исследований, прием Эубикора у данной категории пациентов способствовал дополнительному уменьшению дислипопротеидемии и повышению чувствительности к инсулину .
Лечение неалкогольного ЖГ
В целом требования, предъявляемые к лекарственным средствам, используемым в лечении НЖБП, достаточно высоки. В первую очередь, они должны быть максимально безопасны с точки зрения гепатотоксичности, также желательно их позитивное действие на улучшение клинико-лабораторных и морфологических изменений в печени.
Собственный опыт лечения больных НЖБП на стадии гепатоза состоит в использовании комбинации АЛК с Эубикором. АЛК (препарат «Берлитион», производитель — Берлин-Хеми, Германия) назначалась по 600 ЕД внутривенно в течение 14 дней, с переходом на пероральный прием в той же суточной дозе, однократно в течение 6 месяцев. Эубикор назначался по 2 пакетика 3 раза в день во время еды. Результаты работы показали положительное влияние Берлитион и Эубикора не только на показатели липидного и углеводного обменов, но и на степень жировой дистрофии в печени по результатам ультразвукового и морфологического исследований. Положительная динамика указанных изменений имеет значение как для формирования системной ИР, являющейся основной причиной развития МС, так и для течения собственно НЖБП и развития НАСГ. Поэтому данные препараты, наряду с немедикаментозной терапией, могут рассматриваться как средства базисной терапии первой стадии НЖБП — ЖГ.
Лечение НАСГ
При развитии у пациентов НАСГ терапия заболевания усиливалась дополнительной комбинацией метформина (препарат «Сиофор», производитель — Берлин-Хеми, Германия) в дозе 1500 мг в сутки с УДК (препарат «Урсосан» фирмы PRO.MED.CS Praha a.s.) в дозе 15 мг на 1 кг массы тела, с однократным приемом через час после ужина. Длительность лечения подбиралась индивидуально, как правило, она составляла не менее 6 месяцев, иногда достигая 12 и более месяцев. Продолжительность курса зависела от выраженности клинических проявлений, комплайнса и динамики лабораторно-инструментальных показателей на фоне лечения. Назначение этих препаратов сопровождалось уменьшением не только клинико-лабораторных проявлений заболевания, но и достоверно способствовало улучшению гистологической картины печени. При этом комбинированная терапия у данной категории пациентов являлась методом выбора, поскольку именно в группе, получавшей одновременно Сиофор, Берлитион и Урсосан, динамика показателей синдромов цитолиза, холестаза, а также жирового и углеводного обменов была более значимой. На фоне лечения у больных НАСГ также отмечалось обратное развитие жировой дистрофии, достоверно уменьшилась выраженность воспалительных изменений и отсутствовало прогрессирование стадии фиброза в печени. Таким образом, комбинированная терапия воздействует на основные этиопатогенетические механизмы формирования метаболических нарушений, приводит к улучшению показателей липидного и углеводного обменов в виде нормализации уровней ЛПВП, ТГ и индекса ИР у пациентов с НАСГ.
УДК (Урсосан) 15 мг/кг/сутки.
Гиполипидемическая диета;
Физические нагрузки — не менее 3-4 раз в неделю по 30-40 минут;
Компенсация СД (на фоне диеты в комбинации с пероральными сахароснижающими препаратами или инсулином);
Эубикор по 2 пакетика 3 раза в день;
Метформин (Сиофор) в индивидуально подобранной дозировке в зависимости от уровня гликемии (не назначать пациентам с далеко зашедшими формами НЖБП, с печеночной недостаточностью из-за риска развития лактат ацидоза);
АЛК (Берлитион) 600 ЕД в сутки;
УДК (Урсосан) 15 мг/кг/сутки.
Артериальная гипертензия у больных НЖБП является одним из факторов риска прогрессирования фиброза, поэтому предпочтение при выборе гипотензивного препарата для коррекции уровня артериального давления (АД) должно отдаваться лекарственным средствам из группы антагонистов рецепторов ангиотензина II. Рекомендуемый алгоритм выбора терапии пациентов с НЖБП и артериальной гипертензией:
Таким образом, своевременная диагностика НЖБП и выявление возможных факторов риска неблагоприятного течения заболевания являются важными, поскольку их учет позволяет выбрать адекватный метод лечения, препятствующий дальнейшему прогрессированию НЖБП. В связи с этим все пациенты с МС, имеющие высокую вероятность наличия НЖБП и особенно НАСГ должны быть обследованы с целью оценки морфофункционального состояния печени. При этом, несмотря на то, что формирование стандартов диагностики и лечения НЖБП остается нерешенным вопросом, медицинские специалисты, исходя из существующей необходимости, могут использовать в своей практике предложенные алгоритмы.
По вопросам литературы обращайтесь в редакцию.
С. Н. Мехтиев
В. Б. Гриневич
, доктор медицинских наук, профессор
Ю. А. Кравчук
, кандидат медицинских наук
А. В. Бращенкова
ВМА им. С. М. Кирова
, Санкт-Петербург
- Причины неалкогольной жировой болезни печени
- Неалкогольная жировая болезнь печени: симптомы
- Жировой гепатоз у детей и подростков
- Лечение больных с жировым гепатозом
Жировая неалкогольная болезнь печени (сокращенно НЖБП) имеет и другие названия: ожирение печени, жировой гепатоз, . НАЖБП является болезнью, связанной с уничтожением клеток печени (гепатоцитов). При этом заболевании происходит патологическое запасание жировых липидных капелек. Внутри клеток или в межклеточном пространстве начинают откладываться капли жира. Ядовитые вещества, являющиеся причиной дистрофии печени, могут стать причиной процессов отмирания гепатоцитов или воспалений.
Если содержание триглицеридов (сложных эфиров глицерина и одноосновных жирных кислот) в печеночной ткани превышает 10%, то врачи диагностируют жировой гепатоз. Эта диагностика принята согласно решению конференции американской Ассоциации для исследования болезней печени в 2003 г. Если капли липидов (размером больше ядра) обнаруживаются в половине клеток, то содержание жира в этом органе свыше 25%. Неалкогольный жировой стеатогепатит, согласно клиническим исследованиям, это широко распространенное заболевание. Например, согласно европейским исследованиям, у пациентов, которым делали пункцию печени, оно наблюдалось в 9% случаев.
Симптомы аналогичны признакам алкогольного гепатита: усиливаются энзиматическая активность печени и внешние проявления. У большинства это заболевание протекает без выраженных признаков, но у небольшого процента больных развиваются цирроз, печеночная недостаточность, повышается давление в воротной вене печени. Н. Thaler и С. Д. Подымова (60 гг. XX века) называли это заболевание стеатозом печени с мезенхимальной реакцией. В 80 гг. Н. Ludwig и соавторы назвали его неалкогольным стеатогепатитом.
Причины неалкогольной жировой болезни печени
Факторы развития жирового гепатоза разнообразны. Различают первичную и вторичную формы. Источниками болезни являются:

- избыточная масса тела;
- сахарный диабет второго типа (в частности, приобретенный);
- высокий уровень липидов и холестерина в крови;
- прием фармацевтических средств, отравляющих печень (глюкокортикостероиды, эстрогены, некоторые антибиотики);
- недостаточное усвоение питательных веществ из-за слабого всасывания в тонком кишечнике;
- длительные нарушения работы желудочно-кишечного тракта (язвенный колит, панкреатит);
- слишком интенсивный сброс веса;
- несбалансированное питание, с высоким количеством жиров и быстрых углеводов;
- повышенное количество микроорганизмов в кишечнике из-за потери эластичности его стенок;
- абеталипопротеинемия;
- липодистрофия конечностей;
- синдром Вебера-Крисчена;
- синдром Вильсона-Коновалова;
- псориаз;
- онкологические заболевания, истощающие организм;
- проблемы с сердцем, такие, как ишемия, гипертония;
- легочные болезни;
- подагра;
- порфирия кожи;
- тяжелые воспалительные процессы;
- накопление свободных радикалов;
- нарушение целостности соединительной ткани.
 Врачи считают, что неалкогольная жировая болезнь печени — это вторая стадия заболевания ожирения печени. На клеточном уровне развитие этой болезни связано с повышением уровня токсичных для организма свободных жирных кислот в печени, с одновременным уменьшением скорости их окисления в митохондриальных органеллах клеток на фоне повышения производства жирных кислот. При этом процесс удаления жира нарушен из-за пониженного выделения низкоплотных липопротеинов, которые связывают триглицериды. Известно, что инсулин замедляет разрушение свободных жирных кислот, кроме того, при ожирении организм устойчив к инсулину.
Врачи считают, что неалкогольная жировая болезнь печени — это вторая стадия заболевания ожирения печени. На клеточном уровне развитие этой болезни связано с повышением уровня токсичных для организма свободных жирных кислот в печени, с одновременным уменьшением скорости их окисления в митохондриальных органеллах клеток на фоне повышения производства жирных кислот. При этом процесс удаления жира нарушен из-за пониженного выделения низкоплотных липопротеинов, которые связывают триглицериды. Известно, что инсулин замедляет разрушение свободных жирных кислот, кроме того, при ожирении организм устойчив к инсулину.
При отсутствии лечения болезнь переходит во вторую стадию: формируется стеатогепатит, типичными симптомами которого являются воспалительно-некротические процессы в печени. Свободные жирные кислоты представляют собой хороший субстрат для перекисного окисления липидов (ПОЛ). ПОЛ нарушает мембраны, что ведет к отмиранию клеток и образует огромные по размерам митохондрии.
Альдегиды, результаты работы ПОЛ, усиливают работу клеток печени (звездчатых), производящих коллагены, что нарушает структуру печени.
Наличие свободного жира в печени является переключателем в прогрессировании заболевания и может в редких случаях привести к фиброзу, первым признаком которого является усиление работы липоцитов печени. Согласно теории Баркера задержка внутриутробного развития плода может привести к жировому гепатозу.
 Липидные капли могут быть разных размеров, и их местоположение как внутри клетки, так и вне ее различно. Жиры могут откладываться по-разному, в зависимости от того, в каких фунциональных зонах гепатоцита находятся. Выделяют различные формы жировой дистрофии:
Липидные капли могут быть разных размеров, и их местоположение как внутри клетки, так и вне ее различно. Жиры могут откладываться по-разному, в зависимости от того, в каких фунциональных зонах гепатоцита находятся. Выделяют различные формы жировой дистрофии:
- очаговую диссеминированную, без клинически выраженных симптомов;
- выраженную диссеминированную;
- зональную (в различных зонах дольки);
- диффузную.
Морфологические разновидности этого заболевания могут быть выражены как простым макровезикулярным стеатозом, различимым при проведении ультразвукового обследования, так и стеатогепатитом, фиброзом и даже циррозом.
Часто неалкогольная жировая болезнь печени обнаруживается у больных ожирением и связана с расстройствами метаболизма (гипергликемия, гипертензия и др.) и резистентностью к инсулину.
Вернуться к оглавлению
Неалкогольная жировая болезнь печени: симптомы
Симптомы неалкогольной жировой болезни печени таковы:
- гиперпигментация кожи шеи и подмышек (примерно в 40% наблюдений жирового гепатоза);
- боли в животе и правом подреберье;
- увеличение печени на поздних стадиях;
- увеличение селезенки;
- утомляемость, слабость, боль в голове;
- тошнота, редко рвота, тяжесть в животе, нарушенный стул;
- сосудистые звездочки на ладонях;
- желтушность склеры.
 Функциональные изменения печени сложно выявить стандартными тестами. Типичны для этого заболевания гипертриглицеридемия, уробилиногенурия, замедленная ретенция бромсульфалеина.
Функциональные изменения печени сложно выявить стандартными тестами. Типичны для этого заболевания гипертриглицеридемия, уробилиногенурия, замедленная ретенция бромсульфалеина.
Согласно проведенным исследованиям, среди больных детей преобладают мальчики. А средний возраст появления жирового гепатоза — от 11 до 13 лет. Жировой гепатоз типичен для подростков, причиной этого являются действие половых гормонов и инсулинорезистентность.
Позволяющая точно определить наличие или отсутствие заболевания, для детей применяется редко из-за болезненности и побочных эффектов. В обычной практике диагноз устанавливают при наличии ожирения, инсулинорезистентности, повышении уровня аланина-минотрансферазы (АЛТ) в сыворотке крови и наличии ультразвуковых признаков жирового гепатоза (бедность строения почечной ткани, наличие локальных участков отложения жиров, повышенная эхогенность в сравнении с почечной паренхимой). Для диагностики ранних стадий предложен гепаторенальный сонографический индекс, в норме равный 1,49 (отношение между средним уровнем яркости в области печени и почек).
Этот метод отличается высокой чувствительностью (90%). Ультразвуковое обследование лучше выявляет диффузный жировой гепатоз, а КТ и МРТ — локальные его очаги. К новым методам диагностики относят комплекс биохимических тестов ФиброТест, АктиТест, СтеатоТест, ЭшТест. Это хорошая альтернатива пункционному исследованию.
С изменением возраста клиническая картина изменяется. Жировому гепатозу более подвержены женщины (встречается почти в 2 раза чаще). При беременности может развиться даже печеночная недостаточность с энцефалопатией.